 |
| EDUCAÇÃO HUMANIZADA |

Exemplos de conceitos de Química – matéria, corpo e objeto

Sistema é o que está em observação
Propriedades da matéria
Bons Estudos !
As propriedades da matéria auxiliam na identificação de uma substância e podem ser: físicas, funcionais, químicas, organolépticas, entre outras.
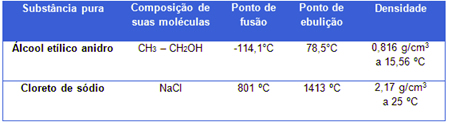
Propriedades físicas do álcool e do cloreto de sódio
- Monoatômicas: é o caso do gás hélio (He), um gás nobre que aparece isolado na natureza, e também do ferro (Fe) e do alumínio (Al), que são metais. Veja o texto Ligação Metálica para entender como os átomos desses elementos permanecem unidos;
- Diatômicas: o gás oxigênio presente no ar atmosférico é constituído por moléculas formadas cada uma por dois átomos de oxigênio, O2, e as moléculas de gás hidrogênio são formadas por dois átomos de hidrogênio, H2;
- Triatômicas: o gás ozônio é formado por três átomos de oxigênio, O3.
Por Jennifer Fogaça
Estados físicos da matéria

O volume, a densidade e a forma de um composto podem variar com a temperatura, sendo assim, os compostos apresentam características de acordo com o estado físico em que se encontram, veja as características de cada um:
Estado Sólido: as moléculas da matéria se encontram muito próximas, sendo assim possuem forma fixa, volume fixo e não sofrem compressão. Por exemplo: em um cubo de gelo as moléculas estão muito próximas e não se deslocam.
Estado Líquido: as moléculas estão mais afastadas do que no estado sólido e os elementos que se encontram nesse estado possuem forma variada, mas volume constante. Além dessas características, possui facilidade de escoamento e adquirem a forma do recipiente que os contém.
Estado Gasoso: a movimentação das moléculas nesse estado é bem maior que no estado líquido ou sólido. Se variarmos a pressão exercida sobre um gás podemos aumentar ou diminuir o volume dele, sendo assim, pode-se dizer que sofre compressão e expansão facilmente. Os elementos gasosos tomam a forma do recipiente que os contém.
Essas características obedecem a fatores como a Força de Coesão (faz com que as moléculas se aproximem umas das outras) e a Força de Repulsão (as moléculas se afastem umas das outras). No estado gasoso a Força de Repulsão predomina, enquanto que no estado sólido é a Força de Coesão.
Assim, quando uma substância muda de estado físico sofre alterações nas suas características microscópicas (arranjo das partículas) e macroscópicas (volume, forma), sendo que a composição continua a mesma.
 |
| EDUCAÇÃO HUMANIZADA |
Distribuição Eletrônica no Diagrama de Pauling
Segundo o cientista Schrödinger, cada elétron da eletrosfera de um átomo possui uma determinada quantidade de energia. Assim, cada elétron só permanece no nível e subnível de energia correspondente.
A distribuição desses elétrons em seus níveis e subníveis de energia é feita de forma crescente de energia. E sua representação gráfica é dada pelo Diagrama de Pauling, criado pelo químico Linus Pauling (1901-1994), que recebeu dois prêmios Nobel, um de Química (1954) e o outro da Paz (1962).
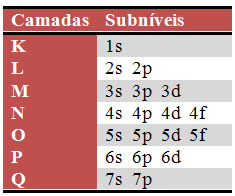
O diagrama de Pauling representa os níveis, que são as camadas eletrônicas do átomo. São sete níveis, enumerados de forma crescente do mais próximo ao núcleo para fora (1, 2, 3... 7) e, denominados, respectivamente, pelas letras K, L, M, N, O, P e Q.
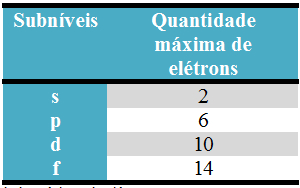
Existem no máximo quatro subníveis, que são: s, p, d, f.
A quantidade de subníveis existentes em cada nível está esboçada abaixo:
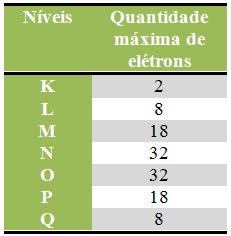
A quantidade máxima de elétrons que pode ser distribuída em cada nível e subnível está evidenciada a seguir:
Visto que, para um mesmo nível, os subníveis têm energias diferentes, nem sempre o subnível energético é o mais afastado do núcleo. Por isso, é importante seguir a ordem crescente de energia dos subníveis no momento de fazer a distribuição dos elétrons. Essa ordem é dada pelas setas indicadoras no Diagrama de Pauling:
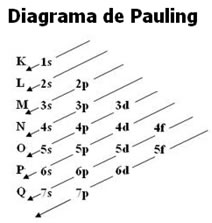
Como ler o diagrama de Linus Pauling
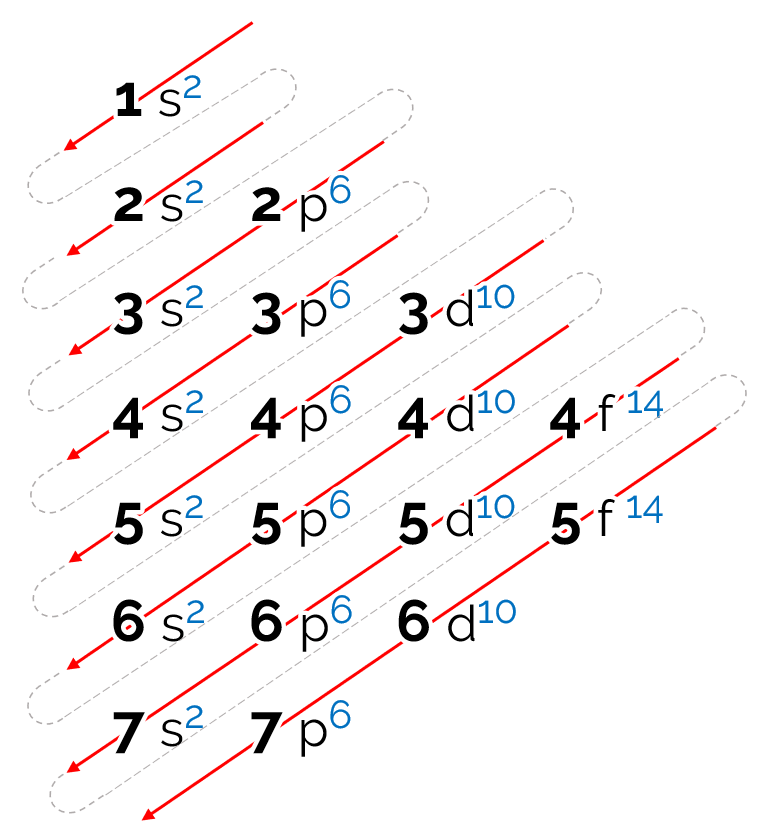
A ordem de energia estabelecida para esse diagrama é na forma diagonal, representado pelas setas em vermelho na imagem acima. É por conta disso que ele também pode ser chamado de diagrama das diagonais. A leitura começa no subnível de menor energia (1s). Seguindo a ordem das setas, o próximo é o subnível 2s. Em seguida, vem o 2p e assim sucessivamente até chegar ao subnível p da camada 7. Os elétrons dos átomos são distribuídos de modo a preencher completamente cada subnível.
Dessa forma, a sequência da distribuição eletrônica é dada na seguinte ordem: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6.
Portanto, veja exemplos de distribuição dos elétrons de dois elementos químicos:
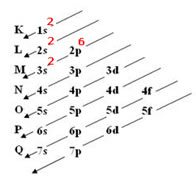
Exemplo 1: Magnésio (12Mg)
Ordem energética da distribuição eletrônica do 12Mg: 1s2, 2s2, 2p6 e 3s2.
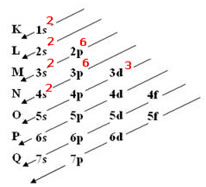
Exemplo 2: Vanádio (23V):
Ordem energética da distribuição eletrônica do 23V: 1s2, 2s2, 2p6,3s2, 3p6, 4s2 e 3d3.
AS LEIS PONDERAIS: LAVOISIER E PROUST
"As leis ponderais são generalizações estabelecidas a partir do estudo das relações entre as massas das substâncias de uma reação química, que é sempre representada a partir de uma equação como a proposta a seguir:
A + B → C + D
Nessa equação, temos A e B antes da seta (indica o sentido da reação), que representam as substâncias responsáveis por promover a reação e, por isso, são chamadas de reagentes. Já as substâncias C e D são originadas a partir de A e B e, por isso, são denominadas de produtos.
Como reagentes e produtos são matérias e apresentam massa, as leis ponderais voltam-se exatamente para as relações entre as massas dessas substâncias. Veja quais são essas leis:
a) Lei da Conservação da Massa de Lavoisier (Lei de Lavoisier)
Foi proposta pelo pai da Química Moderna, o químico Antoine-Laurent Lavoisier. Após realizar diversos experimentos químicos em sistemas fechados, ou seja, que não permitem troca de matéria entre os meios, ele verificou que as substâncias combinadas (os reagentes) durante a reação e as substâncias formadas (os produtos) após a reação sempre apresentavam a mesma massa.
De acordo com Lavoisier, se uma reação química for realizada em um sistema fechado, a soma das massas dos reagentes será sempre igual à soma das massas dos produtos. Veja a generalização da lei de Lavoisier:
Soma das massas dos reagentes = Soma das massas dos produtos
Considere a reação entre a substância A e a substância B, que forma o produto C, como apresentado na equação a seguir:
A + B → C
Se reagirmos 10 g do reagente A com 20 g de um reagente B, obrigatoriamente, se a reação ocorrer em um sistema fechado, a massa do produto C será igual a 30g.
mA + mB = mC
10 + 20 = mC
mC = 30g
b) Lei das proporções definidas de Proust (Lei de Proust)
Foi proposta pelo químico e farmacêutico francês Joseph Louis Proust no ano de 1800. Ele percebeu que os elementos que participam da composição de uma determinada substância pura sempre apresentam uma proporção em massa.
Proust afirmava que, independentemente da forma como uma substância é formada, a sua composição química é sempre a mesma. Considere como exemplo a produção de ácido clorídrico (HCl) a partir de gás cloro (Cl2) e gás hidrogênio (H2):
Gás cloro + gás hidrogênio → ácido clorídrico
Ou
Cl2 + H2 → 2HCl
Em um primeiro experimento, utilizamos 71 g de Cl2 com 2 g de H2, obtendo 73 g de HCl. Já em um segundo experimento, utilizamos 142g de Cl2 com 4 g de H2, formando 146 g de HCl. Por fim, em um terceiro experimento, utilizamos 213 g de Cl2 com 6 g de H2, formando 219g de HCl, como na tabela a seguir:"
EXERCÍCIOS:
01 - Faça a distribuição eletrônica, por Linus Pauling.
a)- Mg
(Z=12)
b)- Cl
(Z=17)
c)- Ca
(Z=20)
02- (Fuvest-SP) Quando 96 g de ozônio se transformam
completamente, a massa de oxigênio comum produzida é igual a:
a) 32 g.
b) 48 g.
c) 64 g.
d) 80 g.
e) 96 g.
03- (UEL-PR) 46,0 g de
sódio reagem com 32,0 gás oxigênio formando peróxido de sódio. Quantos gramas
de sódio serão necessários para obter 156 g de peróxido de sódio?
a) 23,0
b) 32,0
c) 69,0
d) 78,0
e) 92,0
04- Observe a seguir uma tabela
que relaciona certos dados obtidos em algumas reações de síntese realizadas em
laboratório sem excessos de reagentes:
|
Reagente I |
Reagente II |
Produto |
|
A g de grafita |
96 g de gás oxigênio |
132 g de gás carbônico |
|
12g de gás
hidrogênio |
B g de gás nitrogênio |
68 g de gás amônia |
|
80 g de cálcio metálico |
C g de gás oxigênio |
112 g de óxido de cálcio |
|
448 g de ferro metálico |
256 g de enxofre |
D g de sulfeto ferroso |
|
E g de gás hidrogênio |
56 g de gás oxigênio |
63 g de água |
|
48 g de magnésio |
F g de gás oxigênio |
80 g de óxido de magnésio |
Com base na lei de Lavoisier, indique os valores
das massas que substituiriam corretamente as letras A, B, C, D, E e F nessas
reações:
a) 120 g, 56 g, 32 g, 500 g, 63 g, 23 g.
b) 36 g, 80 g, 71 g, 448 g, 56 g, 42 g.
c) 36 g, 56 g, 32 g, 704 g, 7 g, 32 g.
d) 36 g, 56 g, 32 g, 704 g, 7 g, 42 g.
e) 228 g, 80 g, 192 g, 704 g, 119 g, 128 g.
05- Numa dada experiência, foram combinados 3g de carbono e 8g de oxigênio, resultando na formação de Gás Carbônico (CO₂). Se combinarmos 6g de carbono com 16g de oxigênio para formar o Gás Carbônico, qual lei ponderal está sendo aplicada?
ÁCIDOS E BASES:












Nenhum comentário:
Postar um comentário
Observação: somente um membro deste blog pode postar um comentário.